전기화학적 이산화탄소 활용을 위한 탄소 기반 촉매 소재의 기회
- 洪均 梁

- 2023년 7월 4일
- 14분 분량
최종 수정일: 2023년 12월 11일
윤혜원, 유수환, 황윤정* | 서울대학교 화학부, yjhwang1@snu.ac.kr
서 론
산업의 발달과 인구의 증가로 인해 화석 연료 기반의 에너지 사용은 증가하였고, 이는 현대의 경제 성장을 이루는 원동력이 되었지만 동시에 기후 변화를 일으키는 원인이 되었다. 이산화탄소를 비롯한 온실 가스가 지속적으로 공기 중으로 배출될 경우 2050년까지 지구의 온도는 2 ℃ 가량 증가할 것으로 예측되며, 이로 인한 해수면의 상승, 생태계의 변화, 이상 기후의 빈번한 출몰은 인류를 위협하고 있다. 세계 각국이 경제 성장에 타격을 감수하면서도 시급히 이 산화탄소 배출 저감을 위해 노력하는 이유이다. 전 세계는 2050년까지 탄소 배출을 없애는 탄소 중립사회를 목표로 하지만, 현재의 과학 기술 수준은 그 해답을 제공하지 못하고 있다. 우리 나라는 특히 제조업 중심의 국가로 빠르게 경제 성장을 이루면서, 이산화탄소의 배출량이 꾸준히 늘고 있다. 또한, 미국 및 유럽의 다른 국가에 비해서 탄소 저감의 의무가 뒤늦게 대두되면서, 이를 위한 대비가 뒤쳐져 있어, 최근 정부 및 각 산업 기관에서 기술 확보를 위해 적극 적으로 노력하고 있다. 탄소 중립 사회 실현을 위해서 효율 적인 에너지 사용 뿐만 아니라 재생 에너지 기반의 에너지 소비 기술이 중요하게 개발되고 있다. 동시에, 지속가능한 탄소 순환 기술을 확보하기 위해서 이산화탄소를 직접 전환하여 활용하는 기술 개발이 필요하나, 산업화를 위해서 는 앞으로 해결해야 할 과제들이 남아 있다.
전기화학적 이산화탄소 전환 기술은 상온에서의 전환반응이 가능하기 때문에, 불연속 운전이 용이하여 신재생 발전 에너지원과 연계 면에서 장점을 가진다. 또한, 이산화탄소 환원 시에 필요한 수소를 물에서 직접 가져올 수 있기 때문에, H2 기체 생산을 위해 별도의 공정이 필요하지 않는다는 장점을 가지고 있다. 이산화탄소와 물분자를 반응물로 하여 유용한 화합물을 합성하고, 부산물로는 산소를 발생 시키므로 친환경 기술로 각광을 받고 있다. 한편, 전기화학적 촉매 반응은 전극과 전해질 계면에서의 전기이중층이 형성되어, 기상의 촉매 반응과는 다른 특성을 보여 최근 이를 이해하기 위해 많은 연구가 진행되고 있다. 특히, 전기화학적 이산화탄소 전환 반응은 여러 경쟁 반응이 있으며, 전해질의 이온 분포가 반응 경로의 선택성에 영향을 준다. 따라서, 촉매 소재뿐만 아니라 전해질 계면에서의 특성을 같이 이해하는 모델 반응으로 중요하게 연구되고 있다. 1980년대 전기화학적 이산화탄소 전환을 통해 일산화탄소, 개미산, 에틸렌, 메탄, 에탄올 등과 같은 유용한 화합물이 합성 될 수 있다는 것이 보고된 이래 주춤했던 촉매 기술은, 2010 년대 이후 다양한 촉매 소재가 개발되면서 전환 반응의 선택 성 및 전류 효율(패러데이 효율, Faradaic efficiency)이 급격히 증가하였다.[참고문헌 1] 그럼에도 불구하고, 수용액상의 낮은 용해도는 물질 전달의 한계(mass transfer limit)를 야기 시켜, 높은 이산화탄소 전환 속도(reaction rate)을 달성하는데 걸림돌이 되어왔다. 그러나, 최근 10년간의 연구에서 기체확산층(gas diffusion electrode, GDE) 기반 전기화학 반응기 기술의 발전은 전환 속도를 10~100배가량 향상 시키면서, 산업적으로도 기술 경제성을 갖출 수 있을 것으로 전망되고 있다.[참고문헌 2] 소재 합성 및 분석 기술, 연료전지 및 수전해전지와 같은 전기화학 반응기 기반 기술의 발전에 힘입어 전기화학적 이산화탄소 활용 기술도 새로운 전기를 맞이하고 있다. 금속 및 금속 산화물 기반의 전도성을 가지는 소재가 전통적으로 전기화학 촉매 소재로 활용되어 왔으나, 최근에는 탄소 기반의 소재들도 금속기반의 촉매와는 다른 특성을 가지며 촉매 활성을 제어할 수 있다고 보고되고 있다. 특히 전이 금속 및 질소를 도입한 탄소 소재들은 기존의 전이 금속 촉매와 견주어서도 높은 활성을 가질 수 있어 많은 주목을 받고 있다. 본 총설에서는 금속 및 질소를 도입한 탄소 소재들이 전기화학적 이산화탄소 전환에 사용된 최신 연구 및 유망성에 대해서 소개하고자 한다.
본 론
1. 불균일 촉매 전극에서의 전기화학적 이산화탄소 환원 반응성
이산화탄소는 여러가지 탄소 화합물을 연소하여 생성되는 열역학적으로 매우 안정한 분자이다. 따라서, 기체의 이산화탄소를 환원하기 위해서는 높은 활성화 에너지가 필요하며, 환원 반응을 통해서는 여러가지 화합물이 경쟁적으로 생성될 수 있다. 전기화학적 환원 반응에서는 과전압을 제공하여 반응성을 조절하게 되며, 다전자 환원 반응으로 여러 단계를 거쳐 CO, HCOOH (HCOO-), CH4, C2H4, C2H5OH 등의 화합물을 대표적으로 생성할 수 있다. 이중에 CO와 HCOOH는 2전자 환원 반응의 생성물로 다른 생성물에 비해 상대적으로 높은 패러데이 효율과 높은 에너지 전환 효율을 보이며, 전기화학적 이산화탄소 전환 시스템의 대량화(scale-up) 모델로 연구되고 있다.[참고문헌 2] 탄화수소 화합물 합성은 2전자 이상의 환원 반응으로, 반응 경로는 복잡하며 반응성을 이해하는 주요 인자의 연구가 아직 부족하다. 주요 금속 촉매의 반응성은 실험 및 계산화학을 기반으로 기본 기술 인자(descriptor)가 제시되어 촉매 디자인에 지침이 되고 있다. 다만 전기화학적 이산화탄소 환원 반응은 촉매 자체의 특성 이외에 촉매 다공성, 물질 전달, 소수성, 반응기 구조 및 운전 조건 등 환경적인 인자에 의해서도 영향을 크게 받는다. 특히, 촉매 반응 중에는 전해 질과의 계면에서 이산화탄소, 양성자 및 수산화 이온, 양이 온 등 반응과 관련된 물질의 농도 기울기가 생기고 경쟁 반응 간의 선택도에 영향을 끼친다.
전기화학적 이산화탄소 환원 반응의 제안된 메커니즘은 전자 하나가 촉매로부터 전달되어 CO •- 중간체를 형성하면서 반응이 개시된다. 이 과정에서 선형의 대칭적인 이산화탄소 분자의 결합은 구부러지고, 쌍극자 모멘트가 생기는데 이는 높은 활성화 에너지가 필요하다. 반응의 중간체는 전극 촉매 표면에 흡착될 때, 촉매에 따라 *C 또는 *O로 흡착되는 구조의 선호도가 달라질 수 있으며, 반응의 과전압 및 주 반응 경로를 결정짓는다. 추후 이어지는 환원반응에 서 C-O 결합이 깨어지면서 CO를 생성하거나, 탄소원자에 수소화(hydrogenation)가 되면서 HCOO-를 생성한다. 대표적으로, Au, Ag, Zn와 같은 금속 촉매 소재는 CO를 생성 하고, Sn, In, Bi과 같이 산소의 흡착이 선호되는 p-block 금속 촉매 소재는 HCOOH를 생성한다. 또한, *CO의 흡착 에너지가 적당한 세기를 가지는 Cu는 CO가 추가적으로 환원되어 CH4, C2H4, C2H5OH 등을 생성할 수 있다.
한편, 전기화학적 이산화탄소 환원반응은 주로 물을 수소의 공급원으로 사용하기 때문에, 수용액 전해질에서 전기 화학 반응으로 인하여 수소발생반응(hydrogen evolution reaction, HER)이 주요 경쟁반응이 되고, 이러한 수소생성반응을 억제하는 것이 이산화탄소의 환원 성능을 높이는 주요한 전략이 된다. 따라서, 두 반응의 반응성 및 반응 경로를 모두 고려하는 것이 필요하다. 수소발생반응에 대해서 대표적으로 볼머-헤이로프스키(Volmer-Heyrovsky)나 볼머-타펠(Volmer-Tafel) 메커니즘이 제안되었다. 두번째 양성자의 환원 반응이 표면과 전해질 사이의 반응인지, 혹은 표면에 흡착된 중간체 사이의 결합 반응인지에 따라 나뉜다.[참고문헌 3] 유사하게 이산화탄소 환원 반응도 *COOH가 생성된 이후에 *CO를 생성하는 환원 반응에 두 가지 경우를 고려할 수 있다. 전통적으로 높은 촉매 활성을 보인 Pt과 같은 귀금속 촉매는 수소발생반응이 압도적으로 일어나서 이산화탄소 환원 촉매로는 거의 활용되지 못한다. 또한, 금속 기반 촉매 표면에 흡착 세기는 d-band 위치에 영향을 받아, *H 와 *COOH 흡착 세기에는 강한 상관관계(scaling relationship)을 가지고 있다. 이 때문에, 이산화탄소 환원 성능을 높이기 위한 촉매의 디자인은 자주 수소발생반응을 촉진시키는 역효과를 보여 소재 개발에 어려움이 있다. 이에, 수소의 발생 반응은 억제하면서 이산화탄소 환원 반응을 선택적으로 향상시키기 위해서 수전해 촉매와는 차별되는 새로운 촉매 소재 개발 전략이 필요하다.

2. 금속 및 질소가 도핑된 탄소 기반 촉매의 이산화탄소 환원 반응성
전기화학적 이산화탄소 환원반응의 주생성물은 촉매의 구조나 형상 보다는 원소의 종류에 따라서 결정되는 것이 일반적이다. 이러한 특성은 고체 전극 촉매 표면에서의 사바티에(Sabatier) 원리에 근거하여 예측될 수 있다. 촉매 표면에 흡착하는 중간체의 적당한 안정화 에너지가 선호하는 반응 경로를 결정짓기 때문이다. 최근의 이산화탄소 환원 촉매는 단일 원소의 촉매 소재에서 벗어나 다른 종류의 원소를 조합한 합금 촉매로 성능 향상을 시도하고 있다. 또한, 질소가 도핑된 탄소 소재(N-C)는 금속 촉매와는 달리 *COOH와 *CO의 흡착 세기가 따로 제어될 수 있어, 이산화탄소 환원 반응에서 선택적 활성 제어에 유리할 것으로 제안되었다.[참고문헌 4] 뿐만 아니라, 금속 원자는 질소에 의해서 안정화되고, MNx는 이산화탄소 환원 촉매 반응의 활성자리가 될 수 있다. 질소가 도핑된 탄소 구조체에 금속 원자가 분산된 (M-N-C) 촉매들은 최근 다양한 전기 촉매로 활용 되고 있으며, 금속이 원자 단위로 분포되어 원자의 사용을 극대화한다는 장점이 있다. M-N-C 촉매는 금속이 없는 N-C에 비해서, 전기화학적 이산화탄소 환원 반응에서 높은 전환 속도를 가진다. 또한, 도입된 금속 원소의 종류에 따라 이산화탄소 전환 생성물로 CO, HCOOH, CH4, C2H4 등이 가능하다. 전이금속이 도입된 경우에는 대체로 CO를 생성하며, 일부 금속(Mo, In, Sn)의 경우에는 HCOOH를, Cu의 경우에는 CO, CH4, C2H4, C2H5OH 등 여러 화합물을 생성할 수 있는 것이 보고된 바 있다. 한편, CH3OH의 전기 화학적 합성은 다른 생성물과는 별도의 반응 경로를 가지며, 이는 매우 도전적인 과제로 인식되고 있다. Wang 그룹은 Cobalt phthalocyanine이 CNT에 고정되고 주변에 아미노 그룹을 도입한 Co-N-C 구조의 촉매에서 전자 구조가 변하여, 다른 CoPc 촉매와는 달리 CH3OH가 생성될 수 있 음을 특징적으로 보고 하였다.[참고문헌 5] 또한, 이론적 계산 연구에 따르면, 특정 결함 구조를 가지는 Pt-N-C 촉매는 전기화학적인 이산화탄소 환원 반응으로부터 CH3OH 합성이 가능하다고 제안되었다.[참고문헌 6] 이렇듯이 M-N-C 촉매는 중심 금속 원자, 원자 주변의 결합 및 결함 구조, 작용기의 도입, 이종 원소 도핑 등을 다양한 전략으로 금속 주변의 전자 구조를 조절할 수 있어, 새로운 촉매 활성을 기대할 수 있다. 이산화탄소가 환원될 때, M-N-C 촉매에서도 다른 촉매와 유사하게 첫번째 중간체로 CO •-를 형성한다[그림 1A]. 그러나, 촉매마다 반응의 중간체와의 결합 세기 및 단계반응의 상대적 반응 속도 차이가 있다. M-N-C 촉매에 서는 금속 원자의 활성 자리가 원자 단위로 분포되어 있어, 흡착한 중간체끼리 결합하는 이차 반응이 상대적으로 일어나기 어렵다고 예측된다. 따라서, M-N-C 촉매에서 수소 생성반응이 일어나는 경우, 위에서 언급한 헤이로프스키 스텝(Heyrovsky step)이 타펠 스텝(Tafel step)보다 유리할 것이다. 헤이로프스키 스텝은 타펠 스텝보다 일반적으로 높은 과전압이 필요한 것으로 예상하므로, M-N-C 촉매 계열의 경우 수소생성반응이 느려서 이산화탄소 환원 촉매로 사용할 경우 장점이 될 수 있다. 이와 같이 M-N-C 촉매는 기존의 금속 벌크(bulk) 촉매와는 다른 촉매활성을 보일 수 있다. 질소가 도핑된 탄소 및 Ni, Fe, Co와 같 은 전이금속이 질소와 함께 도핑된 탄소 촉매들은 *C를 통해서 중간체가 흡착되고, 추가적인 환원 반응 단계를 거쳐 *CO이 탈착 되면서 주생성물이 된다. Ni, Fe, Co와 같은 전이금속이 벌크 또는 나노 입자 촉매로 사용될 경우, 이산화탄소 환원 반응에는 낮은 활성을 보이고 강한 *H와의 결합으로 인해, 주로 H2를 생성한다[그림 1B].[참고문헌 7] 반면, Ni-N- C 촉매에서는 *H 흡착에너지가 작아지고, 수소발생반응의 과전압이 높아진다. 이산화탄소가 공급되는 환경에서는 CO가 선택적으로 생성될 수 있어, M-N-C 계열에서는 CO를 생성하는 가장 효율적인 촉매로 제안되고 있다.[참고문헌 8] 또한, 전해질의 pH에 따른 반응 속도 연구 결과 이산화탄소 환원 CO 생성 반응의 전류 밀도는 pH에 무관한 의존성을 가진다는 특성을 보인다. 이는 이산화탄소 환원 반응의 속도 결정단계에 양성자 전달이 없이 전자 전달만이 관여할 것으로 이해된다. 따라서, 선택적으로 CO 생성을 할 수 있는 촉매 활성은 첫번째 전자가 투입되는 CO2 분자의 활성 단계가 상대적으로 선호되기 때문인 것으로 이해할 수 있다. 물론, CO 생성 속도를 높이기 위해서는 활성 자리의 전환수(turn of frequency, TOF)를 높이거나, 더 많은 금속 원자를 도입하려는 노력이 계속적으로 필요하다. Ni 주변에 N의 결함이 있는 경우, Ni의 전자 구조가 CO 생성에 더욱 유리할 수 있음이 보고되었다. 한편, 금속의 함량이 높으면서도 나노 입자를 형성하지 않을 때, CO의 생성 전류밀도는 높아지므로 중심 금속의 함량을 높이려는 다양한 M-N-C 합성법이 시도되고 있다. 마지막으로, 이렇게 합성된 M-N-C는 다른 금속 촉매 특히 C-C 결합 반응이 가능한 구리 촉매와의 융합하면 탠덤(Tandem) 촉매로 C2H4 합성 등에도 효과적으로 사용될 수 있다. 이렇듯 M-N-C 계열의 촉매 소재의 확장은 전자구조를 조절하고 촉매 특성에 영향을 주어 전기화학적 이산화탄소 전환 반응에 새로운 기회를 줄 수 있을 것이다.
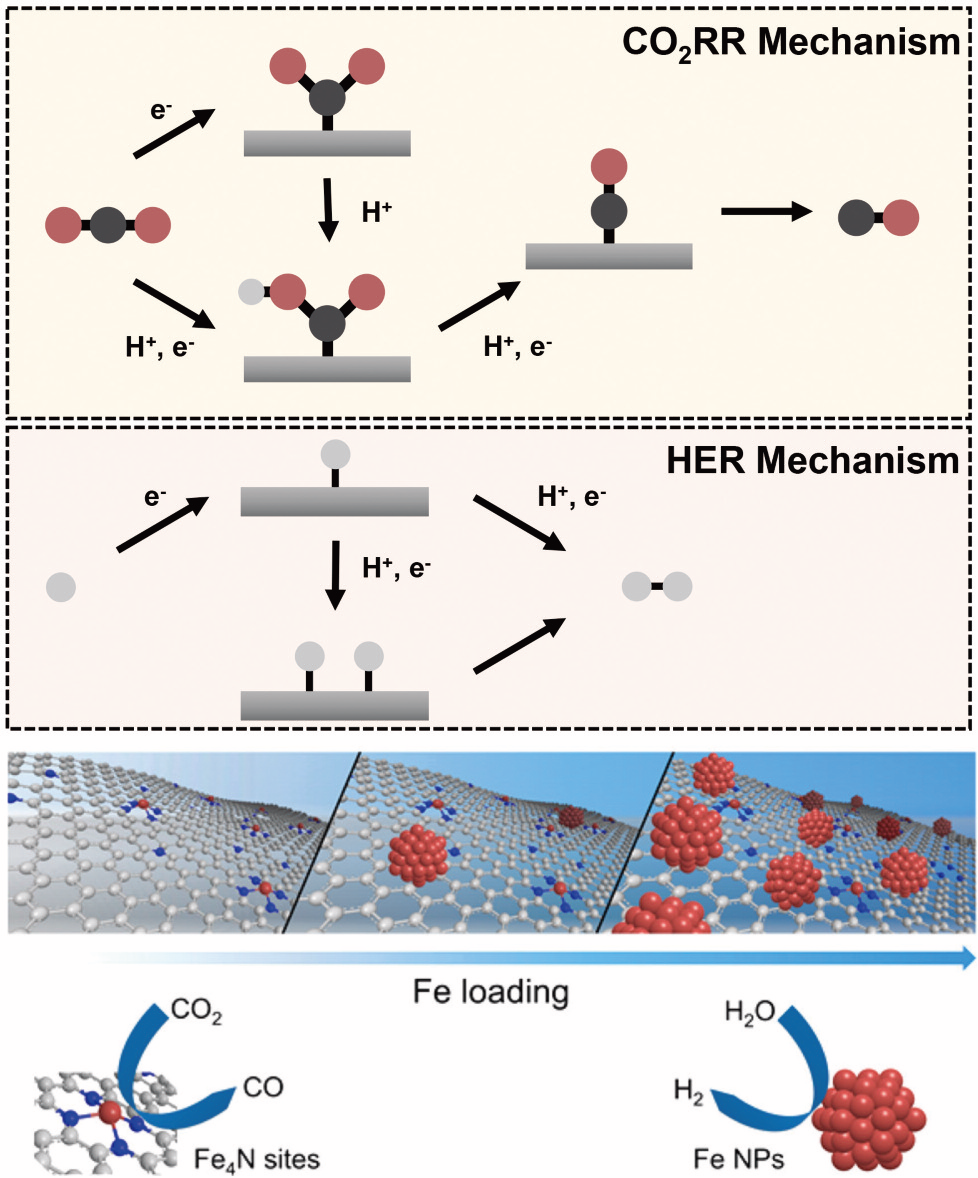
그림 1. (A)기화학적 이산화탄소 환원 반응과 수소 발생 반응의 메커니즘. (B) Fe 원자의 양에 따라 달라지는 반응의 선택도.[참고문헌 7]
3. 전기화학적 이산화탄소 환원 촉매의 내구성
전기화학적 이산화탄소 전환 기술이 산업적으로 사용되기 위해서는 촉매의 내구성 연구가 필요하다. 지금까지의 연구는 이산화탄소 환원 반응의 활성을 높이기 위한 촉매 소재 개발이 주요하게 진행되었으나, 산업에 적용될 수 있는 모델을 제시하기 위해서는 촉매의 내구성이 확보되어야 한다. 이산화탄소 환원 반응은 H2 발생 반응과 항상 경쟁 하기 때문에, 촉매의 활성 저하는 생성 속도뿐만 아니라 생성물의 선택도 변화를 야기한다. 즉, 촉매의 활성이 떨어지면, 많은 경우 이산화탄소 환원 반응은 줄어들고 H2의 발생 반응이 늘어나는 문제점을 가진다. 촉매의 내구성에 영향을 끼칠 수 있는 요인으로는 촉매 형상의 변화, 촉매 활성 자리의 피독 현상, 촉매 표면의 친수성 변화로 인한 수소생성반응의 활성 변화 등이 있으며 촉매 소재 및 전해조 시스템에 따라서 주요 원인은 다르다. 예를 들면, Ag 나노 입자 촉매를 전기화학적 이산화탄소 환원 촉매로 사용하면, CO 생성은 줄고 상대적으로 H2의 생성이 늘어나는데, Ag 표면의 금속이 녹아나고 다시 재증착하는 등 원자들이 재배열되면서 촉매 형상이 변화되는 현상이 관찰되었다.[참고문헌 9] Ag 나노 입자의 형상 변화는 동일한 조건에서 수소발생반응만 일어나는 경우에 비해 이산화탄소 환원 반응 조건에서 형태 변화가 더 빠르다. Cu 촉매의 경우에도, 표면에 *CO가 강하게 흡착하여 Cu 원자의 이동을 야기할 수 있다고 보고되었으며, 활성 자리의 원자가 형상 변화에 더욱 취약하다고 제안되었다.[참고문헌 10] 이러한 촉매의 형상 변화는 표면 금속 원자의 배위수 및 결정면의 변화를 야기시켜, 활성 자리에서 이산화탄소 환원 반응의 선택성 및 활성을 떨어뜨리는 원인이 된다. 한편, Pd는 *H 또는 *CO이 강하게 흡착 할 수 있는 대표적인 촉매 소재로, 강한 흡착에너지는 탈착 속도를 떨어뜨리기 때문에, 활성 자리의 피독 현상으로 촉매의 환원 전류 밀도가 급격히 떨어지는 문제점이 있다. 이와 같이 금속의 촉매는 형상 변화 또는 반응 중간체의 강한 결합으로 내구성 문제를 일으킬 수 있어, 이를 해결하기 위한 전략들이 보완되어야 할 것이다.
한편, 전기화학적 이산화탄소 환원 반응은 전해질내의 불순물에 의해서도 촉매 내구성이 떨어질 수 있다는 것이 보고되었다. 전해질로 사용하는 수용액 내에는 물의 순도 및 사용한 염의 순도에 따라 미량의 금속 불순물(impurity) 이온이 존재한다. 불순물 양이온 중에 Fe, Zn, Cu 은 ppm 이하로 존재하더라도, 이산화탄소 환원 반응을 위해 가해준 음의 전위 조건에서 이 이온들은 먼저 전기 증착(electrodeposition)이 될 수 있다. 전기화학적 이산화탄소 환원 반응 중에 촉매 전극의 표면에 불순물 금속이 증착 되면 촉매 활성이 바뀔 수 있다. 이중에서 Fe는 표면에 증착 되면, 촉매의 활성 자리를 막을 뿐만 아니라 Fe 금속 나노 입자는 수전해 반응에서 수소를 발생하는 촉매이므로, 이산화탄소 전환 활성은 떨어지고 H2의 발생이 늘어나는 원인 이 된다[그림 2A].[참고문헌 11] 이를 막기 위해서, 전해질을 전처리하여 불순물을 제거하면 촉매의 내구성이 향상된다. 그러나 전해질의 전처리는 시간이나 비용면에서 현실적인 해결안이 되지 못한다. 이보다는 불순물에 의해서 영향을 받지 않는 촉매 소재를 개발하는 것이 바람직하다. 질소가 도입된 탄소는 불순물 이온이 존재하는 환경에서도 수백 시간 이상의 높은 촉매 내구성을 가지는 것이 보고되었다[그림 2B]. 불순물 이온의 증착이 금속보다 N-C 표면에서 느리고, 증착이 되더라도 질소와 결합하여 (MNx) M-N-C를 형성하기 때문에 오히려 촉매의 이산화탄소 환원 성능을 향상시킬 수 있으므로 금속 기반의 촉매보다 내구성을 유지하기에 유리하다. 수돗물로 준비된 순도가 낮은 전해질 에서도 N-C와 Fe-N-C 촉매는 이산화탄소 환원 CO 생성의 활성이 장시간 동안 유지되는 것이 보고되었다.[참고문헌 12,13] 불순물 이온에 의한 내구성 저하를 막고 금속 표면에 소수성을 유도하기 위해서 금속 촉매 표면에 탄소층을 도포하여 내구성을 향상시키기도 한다. 탄소 기반 전기 촉매 소재 또는 탄소 지지체가 산화 반응 또는 활성 산소(reactive oxygen species, ROS)가 발생하는 반응에 사용될 경우에 탄소가 산화될 수 있어 촉매 내구성을 확보하는데 문제가 될 것으로 염려되었지만 이산화탄소 전환에서는 전기화학적 환원 반응 조건이므로 안정적일 수 있을 것으로 기대된다. 금속 촉매가 가지는 내구성 단점을 보완할 수 있어, M- N-C 기반 촉매는 전기화학적 이산화탄소 환원 반응에 유망한 대체 촉매가 될 수 있을 것이다.

그림 2. (A) 불순물 양이온으로 인한 촉매의 활성 변화.[참고문헌 11] (B) 순도가 낮은 전해질 조건에서 높은 내구성을 보이는 M-N-C 촉매.[참고문헌 12]
4. 다양한 환경에서의 이산화탄소 환원 반응
전기화학적 이산화탄소 환원 반응의 연구는 실험실 수준에서 성능 확인을 하기 때문에 100 %에 가까운 고순도 이산화탄소를 사용하는 경우가 대부분이다. 그러나 온실가스처리의 관점에서 보면, 화력 발전소의 연소 과정이나 화학 공정에서의 이산화탄소 발생 농도는 5~30 % 수준이고, 공기 중의 이산화탄소는 500 ppm 수준으로 매우 낮은 농도 이다. 따라서, 낮은 농도의 이산화탄소를 직접 사용할 때의 촉매 특성도 고려되어야 한다. 고순도의 이산화탄소에 비해 농도가 낮아지면 부분 압력이 낮아지기 때문에 같은 촉매 조건에서 반응 속도가 낮아진다. 앞서 언급했듯이, 전기 화학적 이산화탄소 환원 반응은 이산화탄소 환원 반응과 수소발생반응이 경쟁적으로 일어나기 때문에, 낮은 농도 조건에서는 이산화탄소 환원 반응의 패러데이 효율이 낮아지고 상대적으로 물분해 수소 생성의 패러데이 효율이 증가 한다. 또한, 낮은 농도 조건에서는 CO, CH4와 같이 C1 화합물이, C2H4와 같은 C2 화합물보다 유리하여 이산화탄소 환원 반응의 생성물 분포에도 영향을 끼칠 수 있다. 이산화탄소의 농도를 100 % 에서 10 %까지 낮추는 경우, 농도에 따른 생성물 분포 경향은 특히 촉매의 내적인 활성(intrinsic activity)에 따라서 달라진다.
촉매 활성 자리가 원자 단위로 분포되어 있는 Ni-N-C는 낮은 수소발생반응의 내적인 활성을 가지며, 활성화 에너지가 금속 촉매에 비해 높게 필요하다. 따라서, 이산화탄소의 농도가 낮아지더라도 상대적으로 CO 생성 반응의 선택도를 높게 유지하고, 수소발생반응이 잘 억제된다. 예를 들면, Ni-N-C와 Ag 두 촉매 모두 고순도의 이산화탄소 환원 조건에서는 CO를 95% 이상 매우 선택적으로 생성하나, 이산화탄소의 농도가 10 %로 낮아지면 Ag 촉매에서는 상대적으로 수소발생반응의 전류 밀도가 높아지면서 CO 생성의 선택도가 40% 수준까지 낮아지고. 반면 수소가 주 생성물이 된다. 반면, Ni-N-C 촉매는 같은 조건의 낮은 이산화탄소 환원 반응에서도 여전히 90 % 이상의 높은 CO 생성 선택도를 보인다[그림 3A].[참고문헌 14] 따라서, 낮은 농도의 이산화탄소 환원 반응 조건에서 높은 CO 생성의 선택도를 유지하기 위해서는 CO 생성 반응과 수소발생반응 사이의 활성화에너지 차이가 클수록 유리하다. 탄소 기반의 촉매는 수소발생을 잘 억제할 수 있어 여러 농도 조건의 이산화탄소 환원 반응에 장점이 있다. 한편, 이산화탄소의 환원 반응은 그 동안 중성 또는 염기성 용액 환경에서 주로 연구되었다. 이는 산성 환경의 전해질에서는 양성자의 농도가 높아 수소발생반응의 속도가 빨라지기 때문이다. 최근에는 이산화탄소의 전환 효율을 높이기 위해서 양이온 교환막을 사용하는 산성환경에서의 전환 반응도 관심 있게 연구되고 있다. 따라서, 산성의 환경에서도 수소발생반응의 성능이 낮은 촉매 소재의 개발이 중요해지고 있다.
전기화학적 이산화탄소 환원 반응은 전극과 전해질 계면에서 양이온의 분포에 의해서 촉매의 활성이 달라지는 현상들이 보고되고 있으며, 특히 생성물의 선택도가 크게 영향을 받아 전기화학적 촉매 반응 중에 양이온의 효과를 연구하는 좋은 모델 반응이다. 양이온이 전기화학적 이산화 탄소 환원 반응의 활성 및 선택도에 영향을 주는 원인에 대해서 여러가지 가능성이 제안되었다. 전기장에 의한 효과, CO •-를 비롯한 이산화탄소 환원 반응의 중간체가 수화된 양이온에 의해 직접 안정화되는 효과, 또는 전극 주변의 pH 및 양성자 전달에 영향을 끼치는 효과들이 제안되었고, 여러 요인들이 복합적으로 작용할 수 있을 것으로 예상된다. 비록 어떤 요인이 결정적인 기여도인지 규명하는 것이 쉽지 않으나, 공통적으로 전극 주변에 양이온이 존재할 때 전기 화학적 이산화탄소 환원 반응의 과전압을 낮추어 활성을 향상시킬 수 있음을 제안하고 있다. 실험적으로 Ag 전극에서 Cs+이 존재할 때 Li+이 존재할 때보다 이산화탄소가 전환 되어 CO가 생성되는 전류 밀도가 증가되는 것이 관찰되었다.[참고문헌 15] 수화된 Cs+ 양이온의 크기가 Li+의 경우보다 작기 때문에, 영점전하(point of zero charge)보다 음의 전위를 전극에 주어졌을 때, Cs+이 촉매 전극 주위에 더 많이 축적되고 이산화탄소 환원 반응의 과전압을 낮추는데 효과적인 것으로 제안되었다. 촉매의 영점전하는 촉매의 일함수 (work function)와 같이 고유의 전자 구조에 의해서 영향 받을 수 있고, 양이온의 변화에 따른 민감도(sensitivity)는 촉매 표면에 따라 다를 수 있다. 양이온의 민감도는 양이온 종류에 따른 이산화탄소 환원의 부분 전류 밀도의 변화 정도로 정의할 수 있다. 단결정 Ag 전극의 결정면에 따라서 영점전하가 달라지고, CO를 생성하는 부분 전류 밀도의 양이온 민감도도 다르다는 것이 보고되었다.[참고문헌 15] 한편, Ni-N- C 촉매는 Ag에 비해서 낮은 양이온 민감도를 가지는 것이 확인되었다[그림 3B]. 물론, 양이온에 따른 민감도 및 의존도는 전해질의 이온 농도 및 pH 등에 따라 달라질 수 있는 특성이다. 같은 농도의 중성 용액에서 Cs+, K+, Na+, Li+ 순으로 알칼리 양이온의 유효 반지름이 커지면, Ag 촉매의 CO를 생성하는 전류 밀도는 급격히 줄어들며, CO 생성의 패러데이 효율도 감소한다. 반면, 같은 전해질 비교 조건에서 Ni-N-C는 양이온의 종류가 변하여도 낮은 민감도를 보이고, 여러 양이온 조건에서 CO의 생성 전류 밀도 및 패러데이 효율이 잘 유지되는 것이 확인되었다.[참고문헌 16] Ni-N-C 촉매는 양의 영점전하를 가지고, 금속 촉매와는 구별되게 양이온의 종류에 따라 활성이 크게 변하지 않는 특성을 가질 수 있음이 제안되었다. 전해질 조건에 따른 낮은 민감도는 반응 중 국부적으로 환경이 변하더라도 촉매의 활성이 안정적으로 유지될 수 있다는 점에서 장점이 될 수 있다.

그림 3. (A) 낮은 이산화탄소의 분압 조건에서도 높은 CO 선택성을 보이는 M-N-C 촉매.[참고문헌 14] (B) 낮은 양이온 민감도를 보이는 Ni-N-C 촉매.[참고문헌 16]
결 론
지속가능한 탄소 순환 기술을 확보하기 위해 이산화탄소를 유용한 화합물로 전환하려는 촉매 화학 기술은 그 동안 많은 관심을 받아왔다. 전기화학적 이산화탄소 전환 기술은 최근의 전지 기술 및 촉매 소재 기술의 발전과 함께 빠른 기술적 성장을 보이고 있다. 초기의 단결정 중심의 금속 촉매 전극 연구는 이산화탄소의 환원 반응의 주요 중간체를 이해하고 촉매의 반응성을 예측하는 가이드라인을 제시해주었다. 그러나, 이산화탄소 전환하는 효율 및 선택성을 높일 수 있는 촉매 소재의 발굴은 계속적으로 필요하다. 특히, 경쟁반응인 수소생성반응을 제어하고 이산화탄소 환원 반응의 안정적인 촉매 성능을 확보하기 위해서는 금속 촉매뿐만 아니라 다양한 소재적 접근도 필요하다. 금속과 질소가 도입된 탄소 기반의 소재는 전도성과 촉매 특성을 모두 보유하고 있어 전기화학적 촉매 소재로 활발히 연구되고 있으며, 특히 이산화탄소 환원 반응에서 전이금속이 도입된 M-N-C 촉매는 매우 선택적으로 일산화탄소를 생성할 수 있다. 낮은 수소발생반응의 촉매 활성은 이산화탄소를 선택적으로 환원시키는데 기여하며 다양한 이산화탄소 환원 조건에서도 높은 활성을 유지할 수 있다. 또한, 탄소 기반의 촉매는 전기화학적 이산화탄소 환원 반응에서 향상된 촉매의 내구성을 보이고 있어 디바이스 적용에도 유리할 것으로 기대한다. 이러한 M-N-C 기반의 소재는 중심원자, 주변의 음이온, 탄소의 구조 등 여러 변수를 조절하여, 촉매의 전자 구조 제어가 다양하게 이루어질 수 있어 새로운 촉매의 활성을 기대할 수 있다.
참고문헌
1. Hori, Y. i., “Electrochemical CO2 reduction on metal electrodes.” Mod. As- pects Electrochem. 2008, pp 89-189.
2. Nitopi, S.; Bertheussen, E.; Scott, S. B.; Liu, X.; Engstfeld, A. K.; Horch, S.;Seger, B.; Stephens, I. E. L.; Chan, K.; Hahn, C.; Nørskov, J., K.,; Jaramillo, T., F.; Chorkendorff, I. “Progress and Perspectives of Electrochemical CO2 Reduction on Copper in Aqueous Electrolyte.” Chem. Rev. 2019, 119 (12), 7610-7672.
3. Zhang, J.; Cai, W.; Hu, F. X.; Yang, H.; Liu, B. “Recent advances in single-atom catalysts for the electrochemical carbon dioxide reduction reaction.” Chem. Sci. 2021, 12 (20), 6800-6819.
4. Wu, J.; Yadav, R. M.; Liu, M.; Sharma, P. P.; Tiwary, C. S.; Ma, L.; Zou, X.; Zhou, X.-D.; Yakobson, B. I.; Lou, J. “Achieving highly efficient, selective, and stable CO2 reduction on nitrogen-doped carbon nanotubes.” ACS nano, 2015, 9 (5), 5364-5371.
5. Wu, Y.; Jiang, Z.; Lu, X.; Liang, Y.; Wang, H. “Domino electroreduction of CO2 to methanol on a molecular catalyst.” Nature 2019, 575 (7784), 639-642.
6. Back, S.; Lim, J.; Kim, N. Y.; Kim, Y. H.; Jung, Y. “Single-atom catalysts for CO2 electro reduction with significant activity and selectivity improvements.” Chem. Sci. 2017, 8 (2), 1090-1096.
7. Huan, T. N.; Ranjbar, N.; Rousse, G.; Sougrati, M.; Zitolo, A.; Mougel, V.; Jaouen, F.; Fontecave, M. “Electrochemical Reduction of CO2 Catalyzed by Fe-N-C Materials: A Structure−Selectivity Study.” ACS Cat. 2017, 7 (3), 1520-1525.
8. Yang, H. B.; Hung, S.-F.; Liu, S.; Yuan, K.; Miao, S.; Zhang, L.; Huang, X.;Wang, H.-Y.; Cai, W.; Chen, R.; Gao, J.; Yang, X.; Chen, W.; Huang, Y.; Chen, H., M.; Li, C., M.; Zhang, T. “Atomically dispersed Ni(i) as the active site for electrochemical CO2 reduction.” Nat. Energy 2018, 3 (2), 140-147.
9. Yun, H.; Kim, J.; Choi, W.; Han, M. H.; Park, J. H.; Oh, H.-s.; Kwak, K.;Hwang, Y. J. “Understanding morphological degradation of Ag nanopar- ticle during electrochemical CO2 reduction reaction by identical location observation.” Electrochim. Acta 2021, 371, 137795.
10. Huang, J.; Hermann, N.; Oveisi, E.; Loiudice, A.; De Gregorio, G. L.; Andreussi, O.; Marzari, N.; Buonsanti, R. “Potential-induced nanoclustering of metallic catalysts during electrochemical CO2 reduction.” Nat. comm. 2018, 9 (1), 1-9.
11. Kim, C.; Choe, Y.-K.; Won, D. H.; Lee, U.; Oh, H.-S.; Lee, D. K.; Choi, C. H.;Yoon, S.; Kim, W.; Hwang, Y. J. “Turning harmful deposition of metal im- purities into activation of nitrogen-doped carbon catalyst toward durable electrochemical CO2 reduction.” ACS Energy Lett. 2019, 4 (9), 2343-2350.
12. Shin, H.; Chung, M. W.; Jung, H.; Chae, K. H.; Oh, H.-S.; Hwang, Y. J.; Min,B. K. “Achieving tolerant CO2 electro-reduction catalyst in real water matrix.” Appl. Catal. B 2019, 258, 117961.
13. Gu, J.; Hsu, C.-S.; Bai, L.; Chen, H. M.; Hu, X. “Atomically dispersed Fe3+ sites catalyze efficient CO2 electroreduction to CO.” Science 2019, 364 (6445), 1091-1094.
14. Kim, D.; Choi, W.; Lee, H. W.; Lee, S. Y.; Choi, Y.; Lee, D. K.; Kim, W.; Na, J.;Lee, U.; Hwang, Y. J. “Electrocatalytic reduction of low concentrations of CO2 gas in a membrane electrode assembly electrolyzer.” ACS Energy Lett. 2021, 6 (10), 3488-3495.
15. Ringe, S.; Clark, E. L.; Resasco, J.; Walton, A.; Seger, B.; Bell, A. T.; Chan,K. “Understanding cation effects in electrochemical CO2 reduction.” Energy Environ. Sci. 2019, 12 (10), 3001-3014.
16. Kim, J. H.; Jang, H.; Bak, G.; Choi, W.; Yun, H.; Lee, E.; Kim, D.; Kim, J.;Lee, S. Y.; Hwang, Y. J. “The insensitive cation effect on a single atom Ni catalyst allows selective electrochemical conversion of captured CO2 in universal media.” Energy Environ. Sci. 2022, 15 (10), 4301-4312.

윤혜원 Hyewon Yun
•서울대학교 화학부 박사과정(2021.9-현재)

유수환 Suhwan Yoo
•서울대학교 화학부 통합과정(2021.9-현재)

황윤정 Yun Jeong Hwang
•한국과학기술원(KAIST) 화학과, 학사(1999.3-2003.2)
•한국과학기술원(KAIST) 화학과, 석사(2003.3-2005.2)
•버클리 캘리포니아 주립대(University of California, Berkeley), 박사(2006.8-2012.5)
•한국과학기술연구원(KIST) 청정에너지연구센터 연구원/선임/책임연구원(2012.6-2021.2)
•서울대학교 화학부 부교수(2021.3-현재)





댓글